Imprimez gratuitement des calendriers, agendas et emplois du temps (année scolaire 2024-2025) !
Editions Petite Elisabeth. Des ressources pédagogiques en mathématiques, physique et chimie pour les collèges, les lycées et la formation professionnelle (CAP, BEP, BP et bac pro).
Électrolyse d'une solution acide de chlorure d'étain
Calculer le volume de dichlore Cl2 formé à l'anode connaissant l'intensité I du courant et la durée t de l'électrolyse.
Constante de Faraday / Volume molaire
/ Volume molaire
|
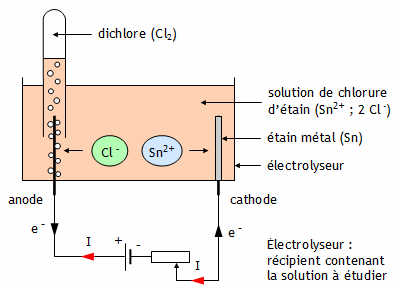
Taper les données Taper les nombres décimaux avec un point et non une virgule, Ne pas laisser d'espace vide entre les caractères. Électrolyse d'une solution acide de chlorure d'étain Une solution acide de chlorure d'étain est une solution ionique : 1. Expérience On plonge deux électrodes de graphite dans une cuve remplie d’une solution acide de chlorure d’étain. Ces électrodes sont ensuite reliées aux bornes d’un générateur de tension continue.
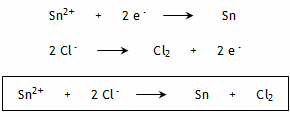
2. Réactions aux électrodes Anode : Les électrons e- perdus par les ions chlorure Cl - sortent par l’électrode reliée à la borne positive du générateur. Cette électrode est donc le siège d’une oxydation, c'est l'anode.
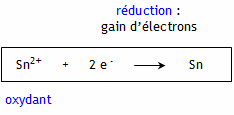
Cathode : Les électrons e- gagnés par les ions Sn2+ entrent par l’électrode reliée à la borne négative du générateur. Cette électrode est donc le siège d’une réduction, c'est la cathode.
Circulation des ions Le passage du courant dans le circuit est assuré par le déplacement des électrons dans les électrodes et les fils extérieurs et par celui des ions dans la solution :
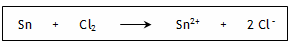
3. Bilan global : Il y a autant d'électrons captés à l'anode que d'électrons cédés à la cathode car il n'y a pas d'accumulation de charges électriques dans le circuit.
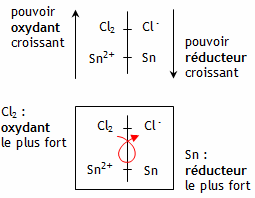
4. Réaction spontanée Les potentiels standards d'oxydoréduction sont E0(Sn2+/Sn) = -0,14 V et E0(Cl2/Cl -) = 1,36 V. L'oxydant le plus fort est le dichlore Cl2 et le réducteur le plus fort est l'étain métallique Sn.
La réaction spontanée est donc
Si on met en présence des ions Sn2+ et Cl - il ne se passe rien. Les électrolyses permettent de réaliser des réactions d'oxydoréduction forcées. On provoque ces réactions d'oxydoréduction inverses des réactions spontanées en apportant de l'énergie électrique au système chimique. |
 Des remarques, des suggestions ! |
© 2009 Editions Petite Elisabeth, tous droits réservés.
SIREN : 514 003 193
APE : 5811Z